Comment Pseudomonas aeruginosa devient plus agressive sous antibiotiques
L'institut de recherche en santé digestive (IRSD) de Toulouse a mis en évidence un mécanisme complexe d’antibiorésistance et de virulence chez P. aeruginosa lié à la présence du gène codant pour la protéine CprA.
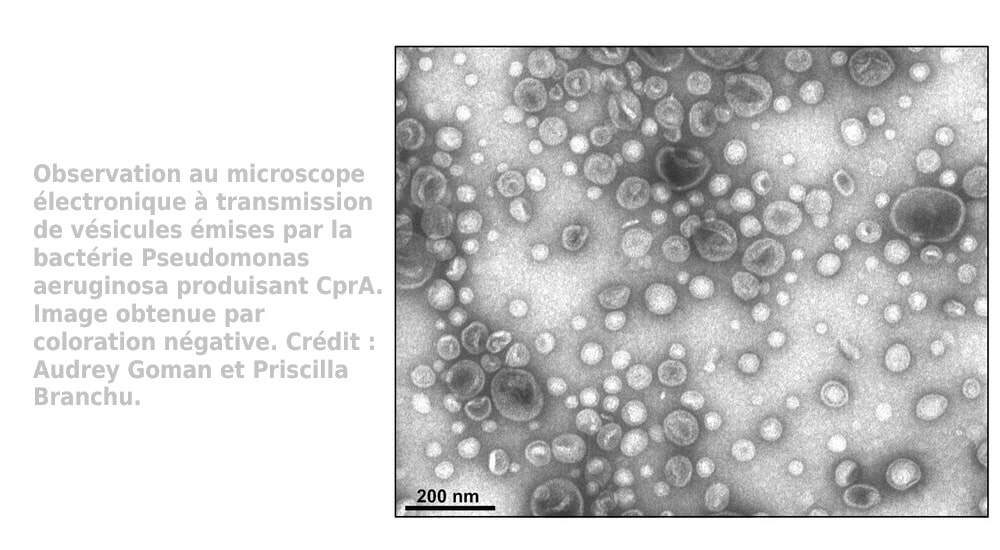
L’étude a été publiée dans Journal of extracellular vesicles, le 22 janvier 2025 sous la coordination du Pr Eric Oswald, praticien hospitalier au CHU de Toulouse. Elle décrit l’un des mécanismes d’antibiorésistance de Pseudomonas aeruginosa qui fait d’elle, une bactérie encore plus virulente quand elle est attaqué par des antibiotiques.
Résistance à la colistine et aux peptides antimicrobiens
Chez P. aeruginosa, la résistance à la colistine et aus peptidex antimicrobiens naturellement produits par le corps pour combattre les infections est fortement liée à la protéine CprA codée par le gène du même nom (cprA) présent chez toutes les souches de P. aeruginosa. Son expression est induite quand la bactérie est traitée à la colistine. Quand il s’exprime, le gène cprA conduit à la production de vésicules provenant de la membrane externe de la bactérie. Ces minuscules vésicules projetées depuis la bactérie perturbent l’autophagie. En paralysant ce mécanisme, la bactérie est mieux protégée. L’infection devient plus grave et les vésicules provoquent une réponse inflammatoire excessive, aggravant les dégâts causés par l’infection. Des expériences menées en laboratoire ont démontré que CprA est essentielle à la virulence de P. aeruginosa. Une version de la bactérie modifiée pour ne pas produire CprA s’est révélée bien moins agressive que la version normale, démontrant l’importance de cette protéine dans la capacité de la bactérie à causer des infections graves.
Une menace sanitaire
Pseudomonas aeruginosa, bactérie Gram négatif représente une menace sanitaire majeure, notamment par son caractère opportuniste. Cette bactérie est particulièrement redoutable dans les unités de soins intensifs et chez les patients atteints de mucoviscidose, où elle peut déclencher des infections respiratoires sévères, qu’elles soient temporaires ou persistantes.
Des vésicules hautement toxiques
Dans son communiqué l’université de Toulouse explique que « L’étude, fruit d’une collaboration de scientifiques français et japonais, révèle que la dangerosité de ces vésicules réside dans leur composition particulière. « L’expression du gène cprA va permettre à la bactérie de modifier les lipides de la membrane bactérienne, conférant aux vésicules qui en sont projetées des propriétés hautement toxiques », souligne Eric Oswald.
Des mécanismes similaires chez d’autre bactéries
Des mécanismes similaires ont été observés par les chercheurs chez d’autres bactéries pathogènes. « Certaines souches très pathogènes de Escherichia coli produisent une protéine, HlyF avec les mêmes propriétés que CprA » Des versions similaires de ces protéines ont également été trouvées lors de cette étude chez d’autres bactéries pathogènes comme Yersinia pestis (responsable de la peste) et Ralstonia solanacearum (responsable d’une maladie redoutable notamment pour la pomme de terre et la tomate).
Ces résultats ouvrent de nouvelles perspectives thérapeutiques prometteuses pour lutter contre des bactéries pathogènes pour l’homme, mais aussi les animaux et les plantes.
Eric Oswald, un parcours « One Health »
Crédit : IRSD-CHU Toulouse
Eric Oswald a commencé son parcours professionnel par des études vétérinaires. Après avoir travaillé au Etats-Unis et à l’INRA, il est désormais chef de service du laboratoire de bactériologie-hygiène du CHU de Toulouse et directeur adjoint de l’Institut de Recherche en Santé Digestive (IRSD). Expert en microbiologie cellulaire et en biologie moléculaire des Escherichia coli pathogènes, son principal thème de recherche est l’étude des toxines et de leur vectorisation. Son groupe travaille en santé humaine et animale pour mieux comprendre la frontière entre les entérobactéries commensales et pathogènes et développer de nouvelles approches thérapeutiques.